Coronavirus: AstraZeneca reanuda pruebas de su vacuna en Estados Unidos
La FDA dio el visto bueno a la farmacéutica una vez que concluyó que era seguro retomar los ensayos
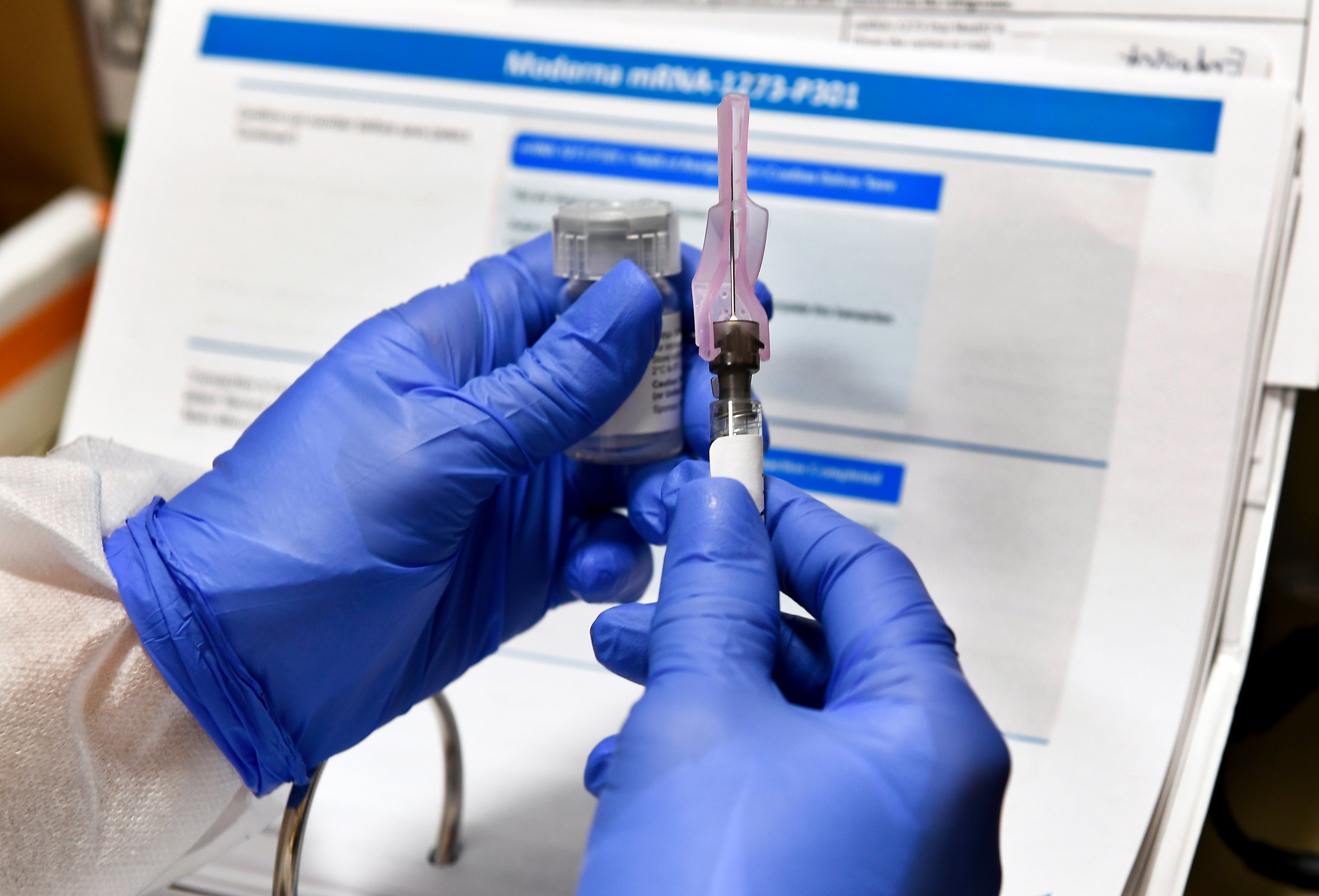
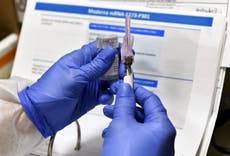
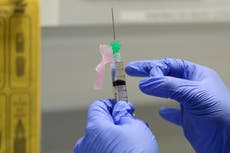
AstraZeneca Inc. anunció el viernes que los reguladores le permitirán reanudar las pruebas de su vacuna candidata contra el COVID-19 en los Estados Unidos.
Las pruebas de la vacuna se detuvieron en todo el mundo a principios del mes pasado debido a la enfermedad de un voluntario del estudio británico. Los estudios ya se han reanudado en otros países y la farmacéutica británica dijo que la Administración de Alimentos y Medicamentos (FDA) dio luz verde a la compañía el viernes para reanudar las pruebas en Estados Unidos.
La vacuna de AstraZenca, desarrollada con la Universidad de Oxford, es una de las varias candidatas en la de etapa final de pruebas en todo el mundo.
El fabricante de medicamentos dijo que se le permitió reanudar las pruebas después de que la FDA "revisó todos los datos de seguridad de los ensayos a nivel mundial y concluyó que era seguro reanudar el ensayo".
La compañía dijo que las pruebas ya se han reanudado en el Reino Unido, Brasil, Sudáfrica y Japón.
Estas interrupciones temporales de las pruebas de medicamentos y vacunas son relativamente comunes, porque en investigaciones que involucran a miles de participantes, es probable que algunos se enfermen. Poner un estudio en espera permite a los investigadores investigar si una enfermedad es un efecto secundario o una coincidencia.
El estudio de AstraZeneca en los Estados Unidos involucra a 30,000 personas, algunas de las cuales reciben la vacuna y otras un placebo.
Las pruebas se detuvieron después de que un participante en el Reino Unido desarrolló síntomas neurológicos severos consistentes con una inflamación poco común de la médula espinal llamada mielitis transversa. Fue la segunda vez que se detuvieron las pruebas de AstraZeneca.
___
Siga a Linda A. Johnson en Twitter: @LindaJ_onPharma
__
El Departamento de Salud y Ciencia de Associated Press recibe el apoyo del Departamento de Educación Científica del Instituto Médico Howard Hughes. AP es el único responsable de todo el contenido.