AP Explica: Proceso para uso de vacuna contra COVID en EEUU
AP Explica: Los pasos finales de la revisión de la Administración de Alimentos y Medicamentos de EEUU para autorizar el uso de emergencia de la vacuna contra coronavirus
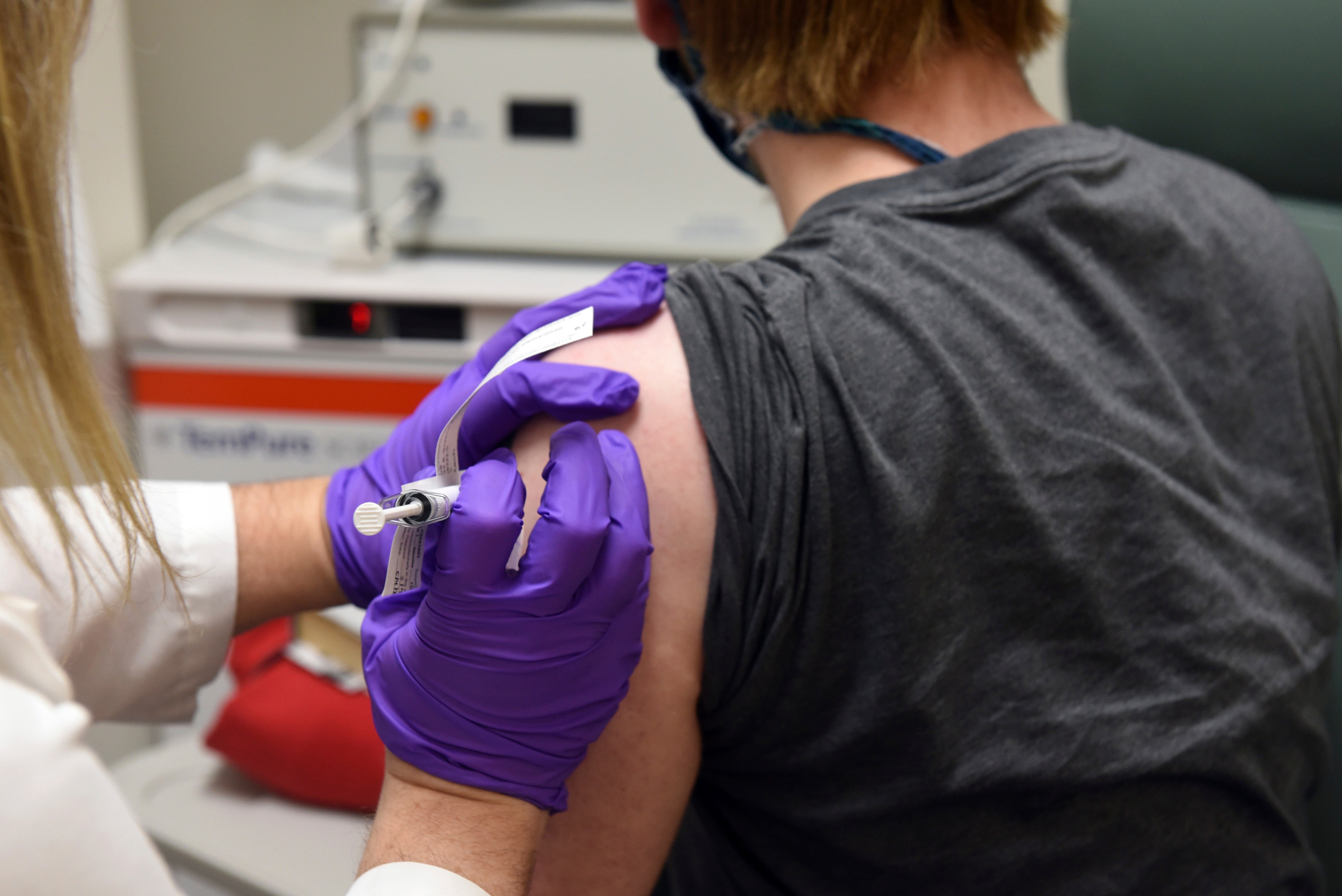
La vacuna contra el coronavirus desarrollada por Pfizer ingresa a su fase final de revisión antes de que el gobierno de Estados Unidos decida si permitir que millones de personas reciban la inyección.
La Administración de Alimentos y Medicamentos (FDA por sus siglas en inglés) publicó el martes una crítica positiva de la vacuna de Pfizer y sostendrá una audiencia pública el jueves. La próxima semana hará lo mismo para la vacuna contra COVID-19 de la farmacéutica Moderna.
Este es un vistazo al proceso que debe seguir una potencial vacuna:
___
REVISIÓN DE LA FDA
La revisión científica de la agencia es un paso clave, no sólo para Estados Unidos, sino para países de todo el mundo que ponderan si empezar a utilizar la vacuna. Los equipos de científicos de la FDA examinan decenas de miles de páginas de información técnica proporcionada por las farmacéuticas, enfocándose en la efectividad, seguridad y efectos secundarios de la vacuna, así como en el proceso de producción necesario para garantizar la calidad y consistencia de las dosis.
Hasta ahora, Pfizer y su socio alemán BioNTech sólo habían publicado resultados mínimos sobre la seguridad de su vacuna y su funcionamiento en comunicados de prensa. Aún deben revisarse los detalles y publicarse en una revista médica.
A diferencia de otras agencias reguladoras del mundo, la FDA vuelve a analizar los datos brutos de la compañía para verificar los resultados. El comisionado de la FDA, Stephen Hahn, dijo que un enfoque cuidadoso tiene mucha importancia más allá de Estados Unidos.
“La FDA es conocida en todo el mundo por sus rigurosos estándares para la seguridad y eficacia”, comentó Hahn a The Associated Press. “Creo que con la información que vamos a proporcionar en la reunión, verán que hemos hecho nuestro trabajo”, añadió.
___
REUNIÓN DE EXPERTOS
El siguiente paso, es una reunión de más de una veintena de expertos, quienes darán su propia evaluación con base en los hallazgos de la FDA. Los expertos tienen experiencia en vacunas, enfermedades infecciosas y estadísticas médicas. No se requiere que la FDA siga su recomendación, aunque generalmente lo hace.
El evento con duración de un día también brinda la oportunidad a la agencia para mostrar su proceso de revisión y tratar de asegurar al público que la vacuna fue examinada independientemente. Esa confianza será crucial para la campaña de vacunación más grande en la historia del país. La reunión concluye con la votación no vinculante del panel sobre si la vacuna debería ser autorizada para su uso en territorio estadounidense.
“Tanto la transparencia como los datos concretos serán muy importante”, señaló Hahn. “¿Qué preguntan los expertos externos a la agencia? Creo que eso será muy esclarecedor para el pueblo estadounidense”.
___
DECISIÓN DE LA FDA
¿Qué tan pronto tomará la FDA una decisión? No existe un plazo para ello, pero Peter Marks, un funcionario de alto rango de la agencia, dijo que esperaba que se emitiera una decisión sobre la vacuna de Pfizer la próxima semana.
Cabe destacar que, si la FDA da su visto bueno, sólo permitiría un uso limitado en ciertos grupos de alto riesgo, debido a que aún no terminan los estudios de la fase final. Eso entra dentro de la “autorización de uso de emergencia” de la FDA, que se utiliza para acelerar la disponibilidad de productos médicos durante una crisis de salud. La decisión equivale a un cálculo cuidadoso entre los posibles riesgos y beneficios.
___
El Departamento de Salud y Ciencia de Associated Press recibe el apoyo del Departamento de Educación Científica del Instituto Médico Howard Hughes. La AP es la única responsable de todo el contenido.